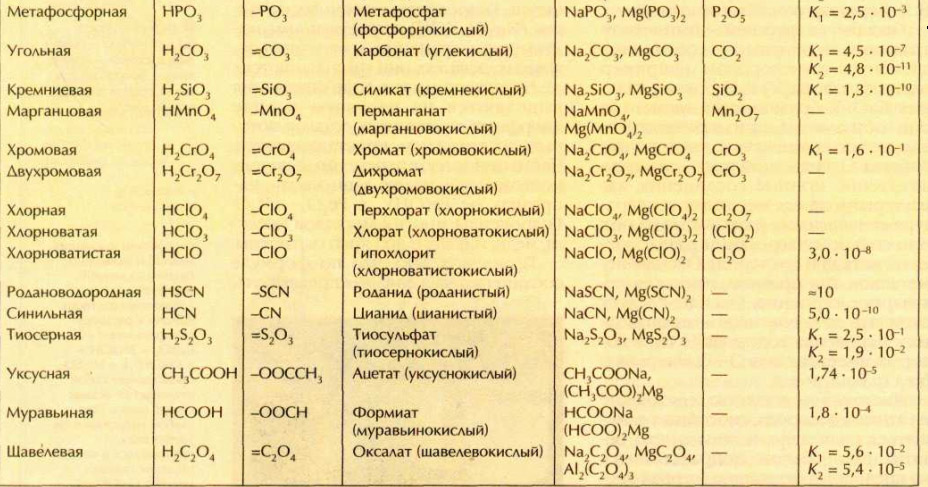
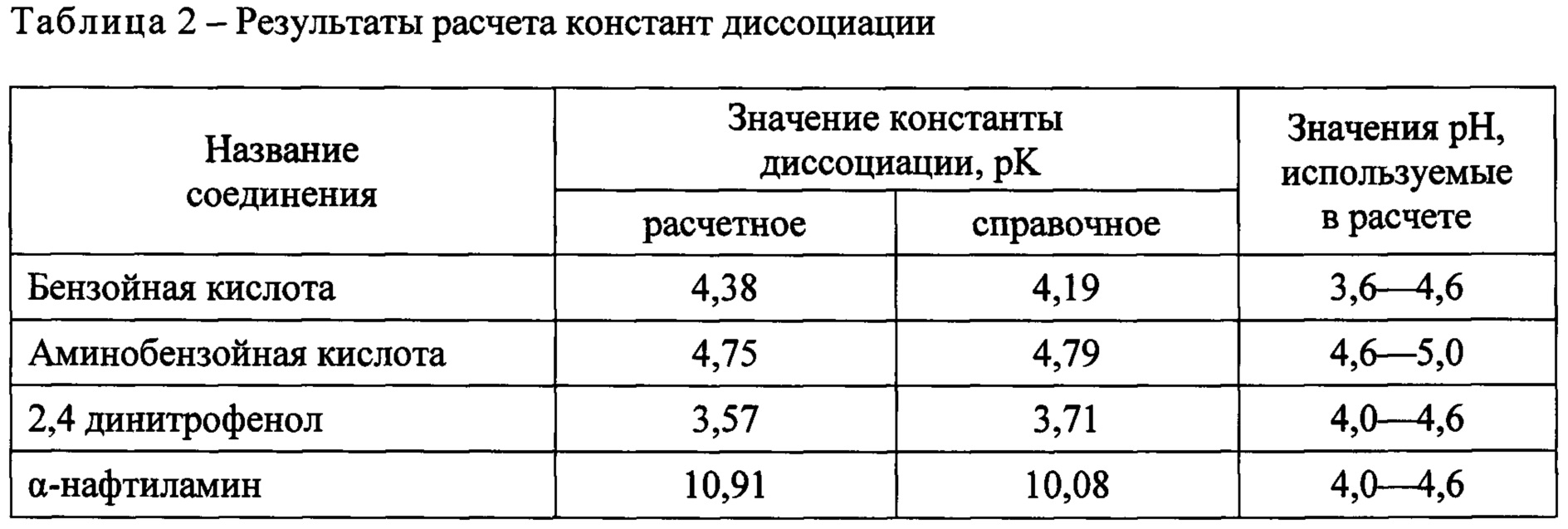
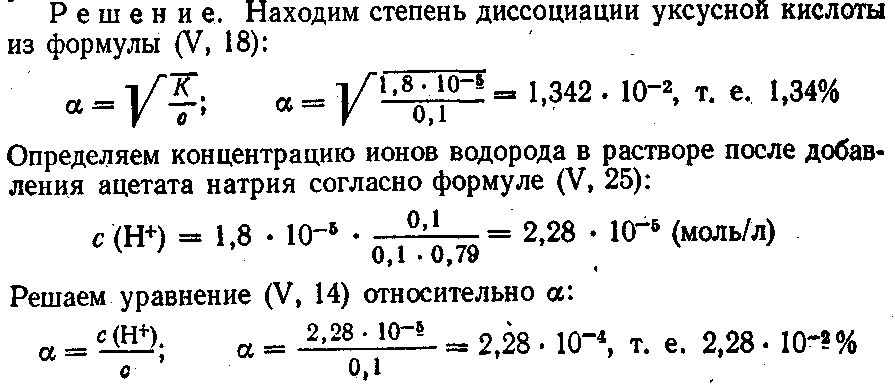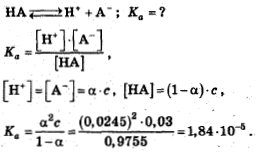Расчеты, связанные с использованием константы диссоциации
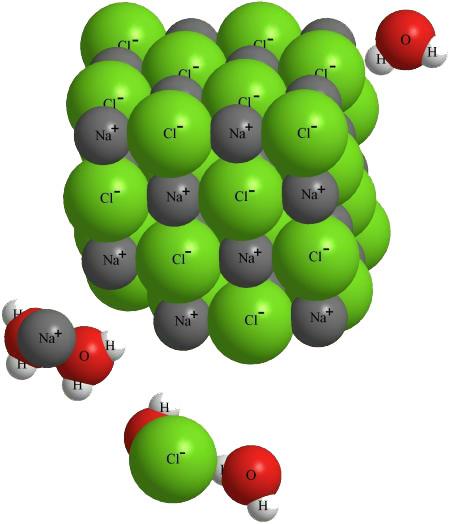
Константа диссоциации — вид константы равновесия , которая характеризует склонность объекта диссоциировать разделяться обратимым образом на частицы, как, например, когда комплекс распадается на составляющие молекулы , или когда соль диссоциирует в водном растворе на ионы. Константа диссоциации обычно обозначается K d и обратна константе ассоциации. В случае с солями, константу диссоциации иногда называют константой ионизации. Электролитическая диссоциация слабых электролитов, согласно теории Аррениуса , является обратимой реакцией, то есть схематически её можно представить уравнениями для одновалентных ионов: :. Константу равновесия такой реакции можно выразить уравнением:.
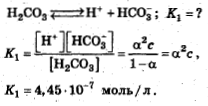





Власенко, Щербаков В. Менделеева, Степень диссоциации. Классификация электролитов.
- Глава 2. Электрохимия
- Учебные материалы по физической химии Задачи по физической химии.
- Phone or email.
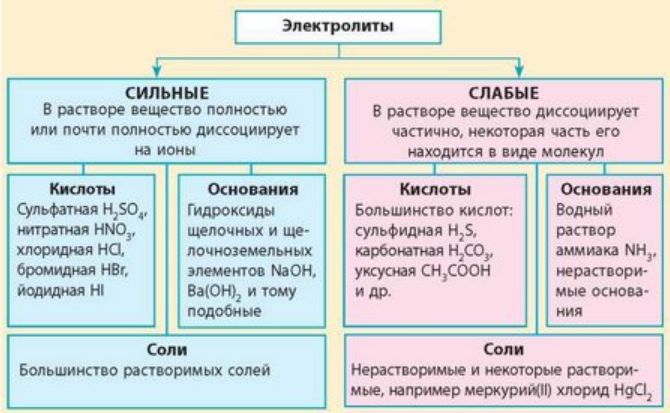
- В растворе слабого электролита устанавливается равновесие между молекулами и ионами, которые образовались в результате диссоциации электролита. Диссоциация слабых кислот обратима, поэтому в растворе устанавливается химическое равновесие.









Автор юлияхарченко , 27 Ноября, в в Решение заданий. Слабые электролиты , степень диссоциации , рН, буферные растворы. Закон разбавления Оствальда , применяемый в решении большинства задач по данной теме, выражается формулой:. Так и понимать, 0,1 нормальный раствор.